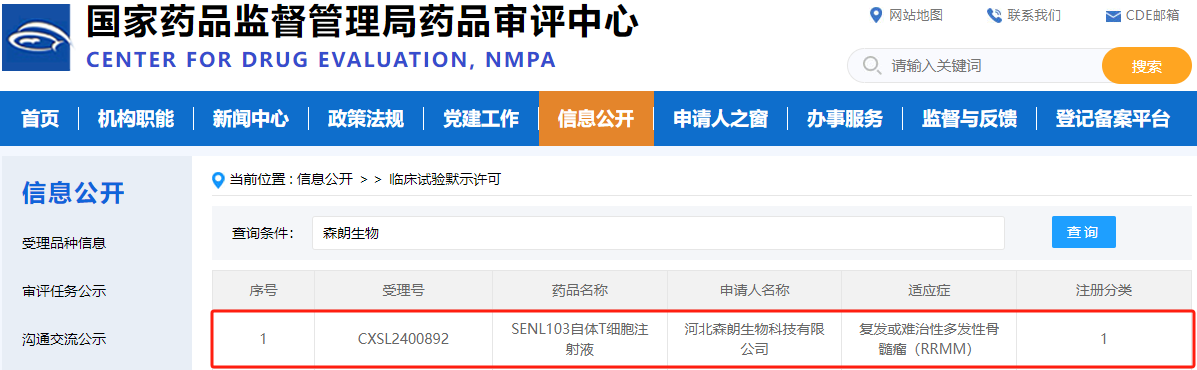
2025年3月19日,国家药品监督管理局药品审评中心(CDE)官网显示,河北森朗生物科技有限公司自主研发的“SENL103自体T细胞注射液”新药临床试验(IND)申请正式获得默示许可(受理号:CXSL2400892),其适应症为复发或难治性多发性骨髓瘤(RRMM)。
SENL103自体T细胞注射液是森朗生物自主研发的具有完全自主知识产权的Ⅰ类新药,是基于森朗生物纳米抗体CAR筛选和验证平台开发的创新型CAR-T产品,将为复发或难治性多发性骨髓瘤患者带来新的希望和治疗选择。
关于森朗生物
河北森朗生物科技有限公司成立于2016年1月,位于石家庄市国际生物医药园,是专注于创新型免疫细胞治疗药物研发生产及临床转化的高科技生物医药企业,已有多款first-in-class/first-in-safe的产品处于临床试验阶段。森朗生物拥有多个独创性的核心技术平台,包括快速纳米抗体CAR筛选和验证平台、高效质粒病毒制备平台、高性价比CAR-T细胞制备平台等;产品管线布局广泛,包括自体CAR技术、通用CAR技术,适应症覆盖血液肿瘤和自身免疫类疾病。森朗生物已与北京大学人民医院等多家国内知名临床机构合作,成功救治了上千例晚期癌症患者。公司创新型产品“SENL101自体T细胞注射液”可突破性用于CD7阳性T细胞起源的血液淋巴系统恶性疾病治疗,获得FDA孤儿药资格认定,填补了国际空白,目前处于I期临床试验阶段。


