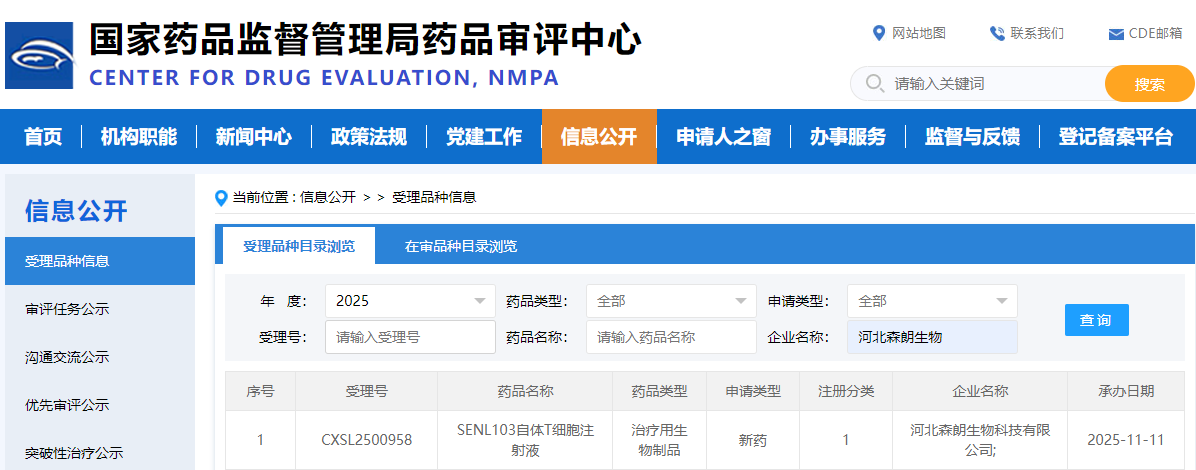
2025年11月11日,国家药品监督管理局药品审评中心(CDE)官网显示,河北森朗生物科技有限公司自主研发的“SENL103自体T细胞注射液” IND 申请再次获得 CDE 受理。(受理号:CXSL2500958),其适应症为系统性轻链(AL)淀粉样变性。
AL型淀粉样变性是一种罕见的全身性疾病,其特征是错误折叠的免疫球蛋白轻链(LC)蛋白产物以不溶性纤维形式在多个器官中沉积,主要与克隆性浆细胞异常增殖有关。目前,AL型淀粉样变性的常用疗法主要是烷化剂、自体造血干细胞移植、蛋白酶体抑制剂和免疫调节剂等,但它们疗效有限,研究表明,此类治疗方案在AL型淀粉样变性的临床应用中的CR均在25%-39%之间,且临床应用存在预后不良以及安全性问题等局限性。
SENL103自体T细胞注射液是森朗生物自主研发的具有完全自主知识产权的Ⅰ类新药,是基于森朗生物纳米抗体CAR筛选和验证平台开发的创新型CAR-T产品,该药物已在复发或难治性多发性骨髓瘤(RRMM)以及难治性全身型重症肌无力(rgMG)两个适应症上获得国家药品监督管理局药品审评中心(CDE)的临床批准。本次系统性轻链(AL)淀粉样变性的IND申请受理,进一步拓展了SENL103自体T细胞注射的适应症范围,将成为改善AL患者器官功能和生存的有力工具。


