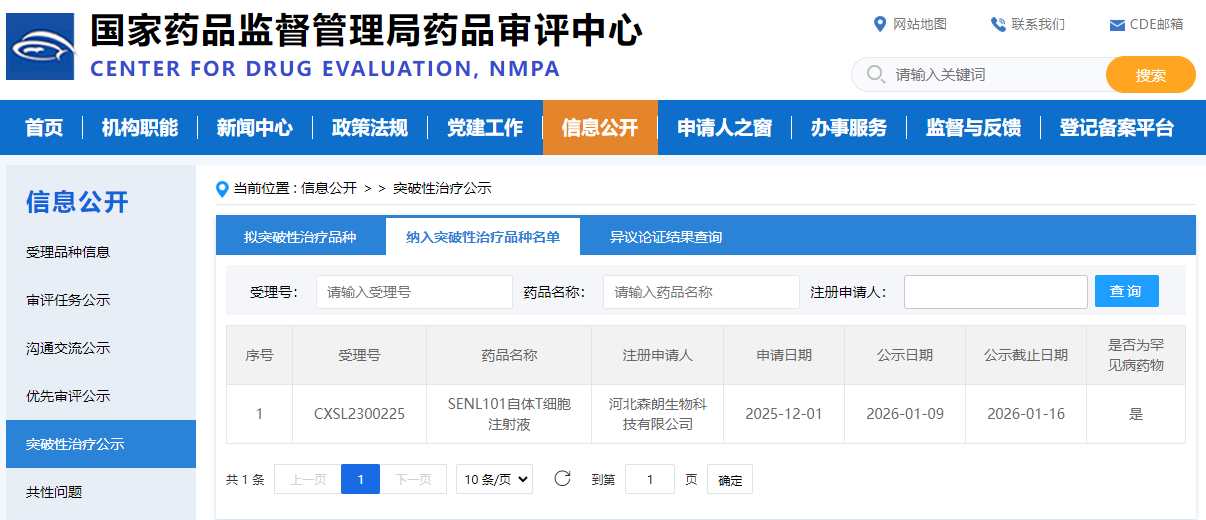
近日,河北森朗生物科技有限公司旗下核心产品“靶向 CD7 的CAR-T细胞产品(SENL101自体T细胞注射液)凭借出色的临床数据和显著的治疗潜力,纳入CDE突破性治疗品种,拟定适应症为成人 复发或难治性 T 淋巴母细胞淋巴瘤/白血病(T-LBL/ALL)。
该产品采用独特的「自然选择」技术平台,无需针对CD7进行基因编辑,在Ⅰ期临床 ARMA-I研究中,总体 ORR高达87.5%(14/16),其中 62.5%(10/16)的患者达到了 CR/CRi;安全性方面,87.5%(14/16)的受试者出现细 CRS,但绝大多数为1级或2级,且无ICANS事件发生;已展现出良好的安全性及有效性,相关数据已发表于 Blood 和 American Journal of ematology。
目前,支持SENL101自体T细胞注射液上市的关键Ⅱ期临床研究已启动,并将在临床试验期间评估结果,申请附条件上市批准与优先审评审批,以加速产品上市。
SENL101自体T细胞注射液的破性进展,不仅是单一产品的成功,更意味着该产品的科学价值、临床潜力以及公司开发策略获得了多方肯定。森朗生物将以患者需求为核心,加速推进Ⅱ期临床试验,同步完善商业化生产布局,全力推动这一源自中国的创新细胞治疗产品早日上市,不仅惠及中国患者,更为解决全球T细胞肿瘤患者的治疗难题贡献中国智慧与方案。


