
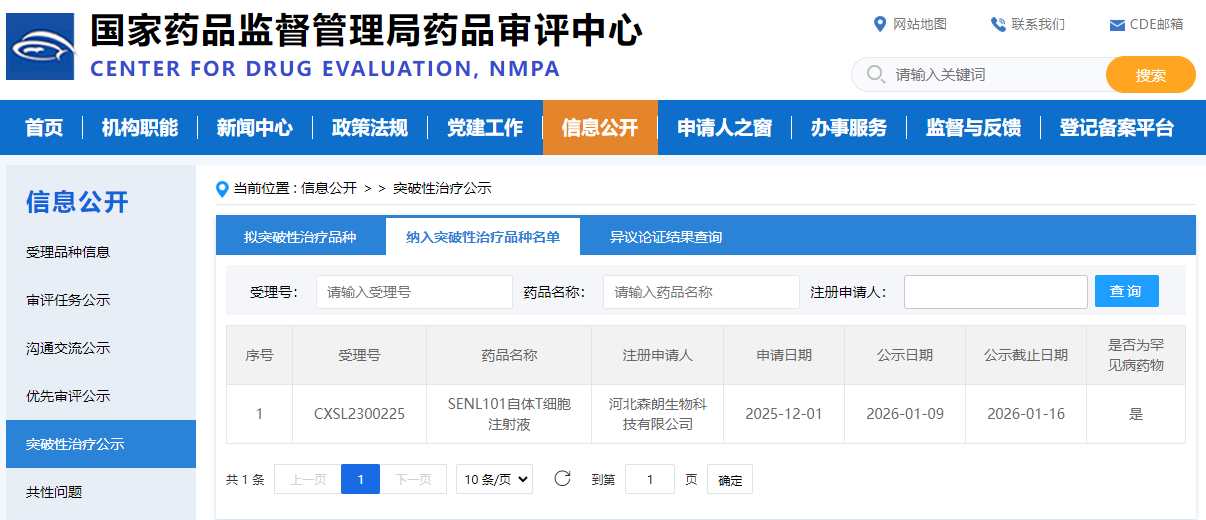
近日,河北森朗生物科技有限公司旗下核心产品“靶向 CD7 的CAR-T细胞产品(SENL101自体T细胞注射液)凭借出色的临床数据和显著的治疗潜力,纳入CDE突破性治疗品种,拟定适应症为成人复发或难治性 T 淋巴母细胞淋巴瘤/白血病(T-LBL/ALL)。该产品采用独特的「自然选择」技术平台,无需针对CD7进行基因编辑,在Ⅰ
查看详情
近日,国际呼吸学领域顶级期刊《European Respiratory Journal》报道了森朗生物CD19 CAR T细胞治疗结缔组织病相关肺动脉高压(PAH)病例的临床研究成果,证实了细胞治疗在对传统免疫抑制治疗无效的CTD相关PAH中的潜在疗效。肺动脉高压(PAH)是结缔组织病(CTDs)的严重并发症,涉及系统性硬化症(SSc)、系统性红斑狼疮(S

近日,河北省科学技术厅公布了2025年度新建河北省技术创新中心公示名单。由河北森朗生物科技有限公司牵头联合北京大学人民医院共同申报的“河北省嵌合抗原受体细胞技术创新中心”经严格评审,成功获批为省级技术创新中心。河北省技术创新中心作为全省科技创新体系的核心载体,正成为激活企业创新活力、推动产业转型升级的关

近日,来自中国的全球CAR-T细胞药物自主创新引领者--森朗生物宣布,公司将于2025年12月6日-9日亮相在美国佛罗里达州奥兰多市举行的第67届美国血液学会(ASH)年会。公司旗下核心产品CD7靶点产品SENL101、CD19/BCMA双靶点产品SL1703、CD19/CD20双靶点产品SL1716和BCMA/GPRC5D双靶点产品SL0439等6项最新临床研究成果将在本届大
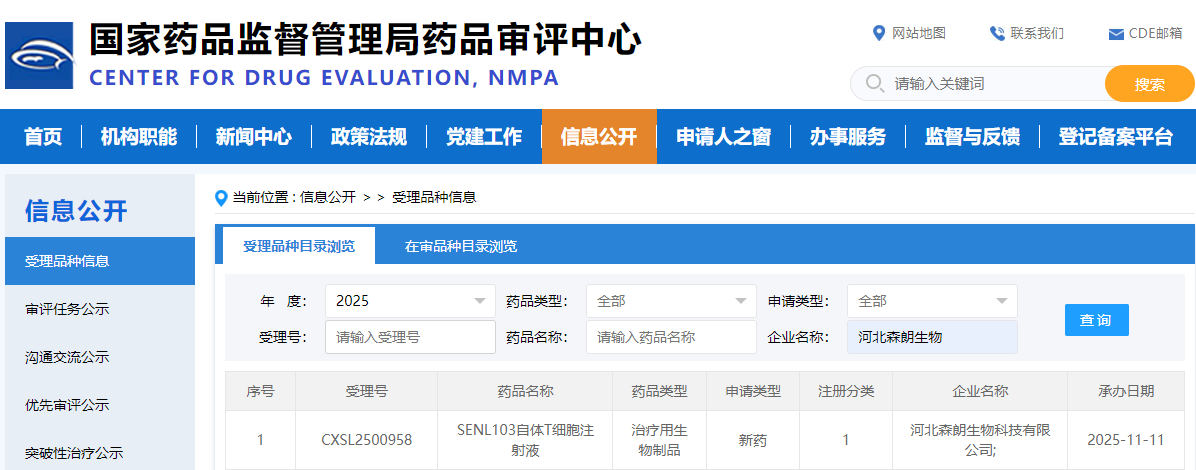
2025年11月11日,国家药品监督管理局药品审评中心(CDE)官网显示,河北森朗生物科技有限公司自主研发的“SENL103自体T细胞注射液”IND 申请再次获得 CDE 受理。(受理号:CXSL2500958),其适应症为系统性轻链(AL)淀粉样变性。AL型淀粉样变性是一种罕见的全身性疾病,其特征是错误折叠的免疫球蛋白轻链(LC)蛋白产物

近日,国际知名血液学期刊《British Journal of Haematology》报道,复发/难治性T淋巴细胞白血病/淋巴瘤(R/R T-ALL/LBL)患者在接受森朗生物靶向CD7 CAR-T细胞治疗后的免疫重建最新研究成果,为全球广泛关注的CD7 CAR-T后免疫缺陷风险问题提供了重要临床证据。该研究由陆道培医院血液科张弦主任系统评估了60例复发/难治性T

近日,国际血液学领域顶级期刊《Blood Advances》报道了森朗生物自主研发的靶向BCMA纳米抗体CAR-T细胞(S103)多线治疗后难治复发的浆细胞肿瘤的突破性临床研究成果。该研究通过与合作单位河北燕达陆道培医院和北京陆道培医院联合开展,研究数据表明,该产品具有很好的治疗效果和安全性,为这些患者提供了新的治疗希望。本研

河北森朗生物科技有限公司作为创新型免疫细胞治疗药物研发、应用的高科技生物医药企业,凭借卓越的自主创新能力和发展潜力荣获“2025年石家庄高新区创新持续领先者企业”称号。本次领先者企业评选由石家庄高新区科技局发起,基于火炬中心大数据成长性判断标准,结合问卷调研、访谈、数据汇总及数据核查等基本流程,遴选出当

中华人民共和国国务院令第818号《生物医学新技术临床研究和临床转化应用管理条例》已经2025年9月12日国务院第68次常务会议通过,现予公布,自2026年5月1日起施行。总理 李强 2025年9月28日 近日,国务院第68次常务会议审议通过《生物医学新技术临床研究和临床转化

近日,第十七届中国生物产业大会2025生物制造创新创业大赛在武汉举行,河北森朗生物科技有限公司(以下简称“森朗生物”)凭借其创新项目《重症肌无力新希望-靶向BCMA的CAR-T细胞I类新药研发与应用》,在激烈的竞争中脱颖而出,荣获总决赛季军。本届大赛以“生物科技赋能未来,生物制造重塑世界”为主题,汇聚了国内外生物医